-
科研进展 | 朱宸与KAUST Magnus Rueping团队在Nature Synthesis发表电镍协同催化偶联最新成果
科研聚焦 | 2023-08-31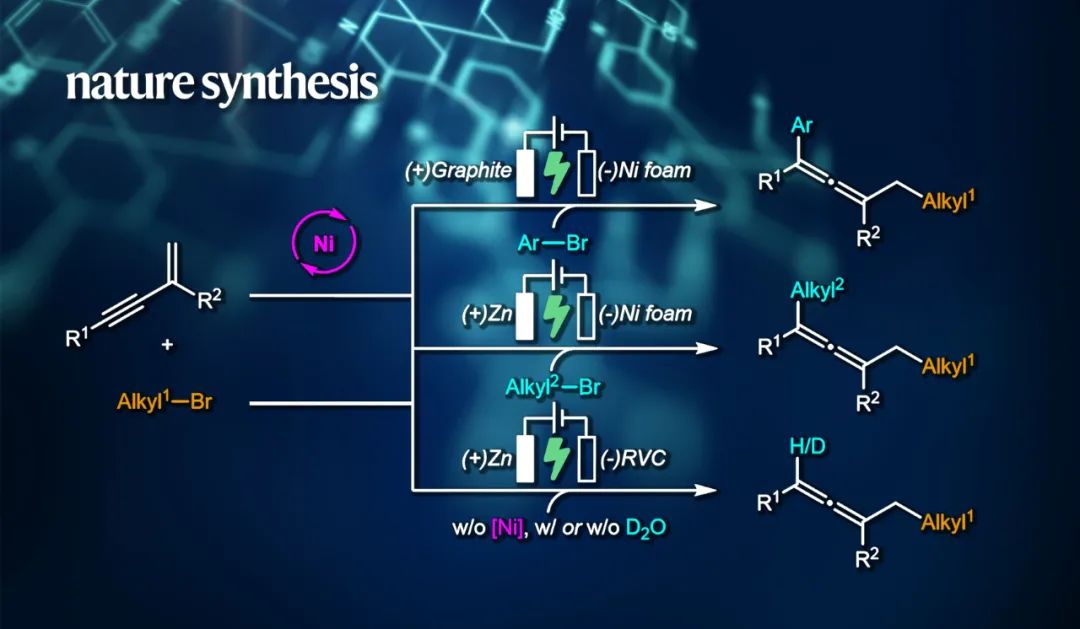
近日,宁波东方理工大学(暂名)理学部朱宸助理教授与阿卜杜拉国王科技大学(KAUST)Magnus Rueping教授团队合作,在Nature Synthesis发表题为“Electrochemical chemo- and regioselective arylalkylation, dialkylation and hydro(deutero)alkylation of 1,3-enynes”的研究论文。
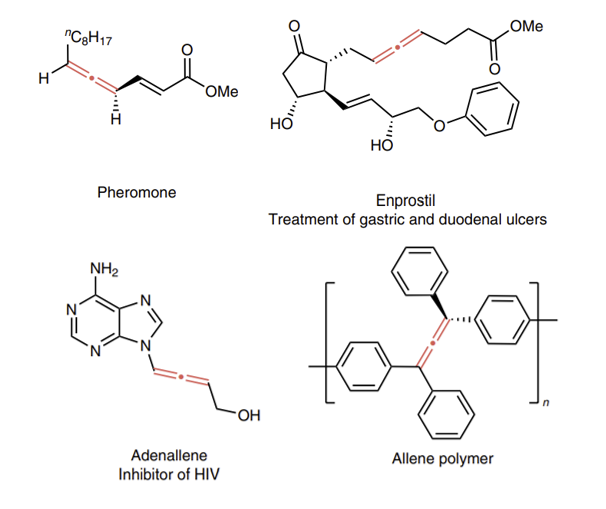
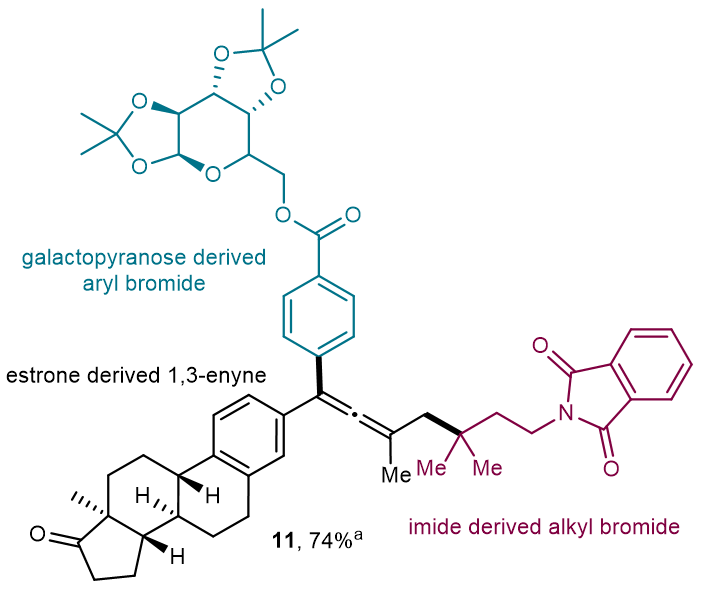
该工作实现了1,3-烯炔的芳基烷基化、非对称双烷基化、氢烷基化,以及更重要的氘代烷基化反应。这种温和高效的电化学方法为合成结构和功能各异的联烯化合物提供了一个多功能的平台。这个反应具有广泛的官能团容忍性和良好的化学选择性和区域选择性,使得它在合成含联烯的天然产物和药物类似物等复杂分子方面具有较大的应用潜力。
该研究发表于Nature Synthesis,其中东方理工朱宸和KAUST陈海峰为本文共同第一作者,福州大学岳会锋与KAUST Magnus Rueping为本文共同通讯作者。
论文链接:
https://www.nature.com/articles/s44160-023-00349-9